Förberedelse läkarutbildningen
-
Dr. Faustis
- Newbie-postare

- Inlägg: 24
- Blev medlem: tor 17 okt, 2019 12:22
Förberedelse läkarutbildningen
Hej!
Jag ska nu börja läsa läkarprogrammet, men eftersom det var bra många år sedan jag gick ur gymnasiet, så undrar jag vad man kommer behöva kunna, eller ha färskt i minnet. Vad bör jag ha full koll på när jag börjar, som citronsyracykeln, glykolysen, eller har man repetitioner tillsammans i början. Vad kan man sedan även läsa djupare om för att förbereda sig under T1?
Jag ska nu börja läsa läkarprogrammet, men eftersom det var bra många år sedan jag gick ur gymnasiet, så undrar jag vad man kommer behöva kunna, eller ha färskt i minnet. Vad bör jag ha full koll på när jag börjar, som citronsyracykeln, glykolysen, eller har man repetitioner tillsammans i början. Vad kan man sedan även läsa djupare om för att förbereda sig under T1?
-
Kunskapärmakt
- Stammis

- Inlägg: 182
- Blev medlem: mån 31 dec, 2018 16:22
Re: Förberedelse läkarutbildningen
Vilket universitet kom du in på, tänkte dra iväg ett mail till Uppsala
Re: Förberedelse läkarutbildningen
Skickade en liknande fråga till studievägledningen på LiU, detta var svaret.
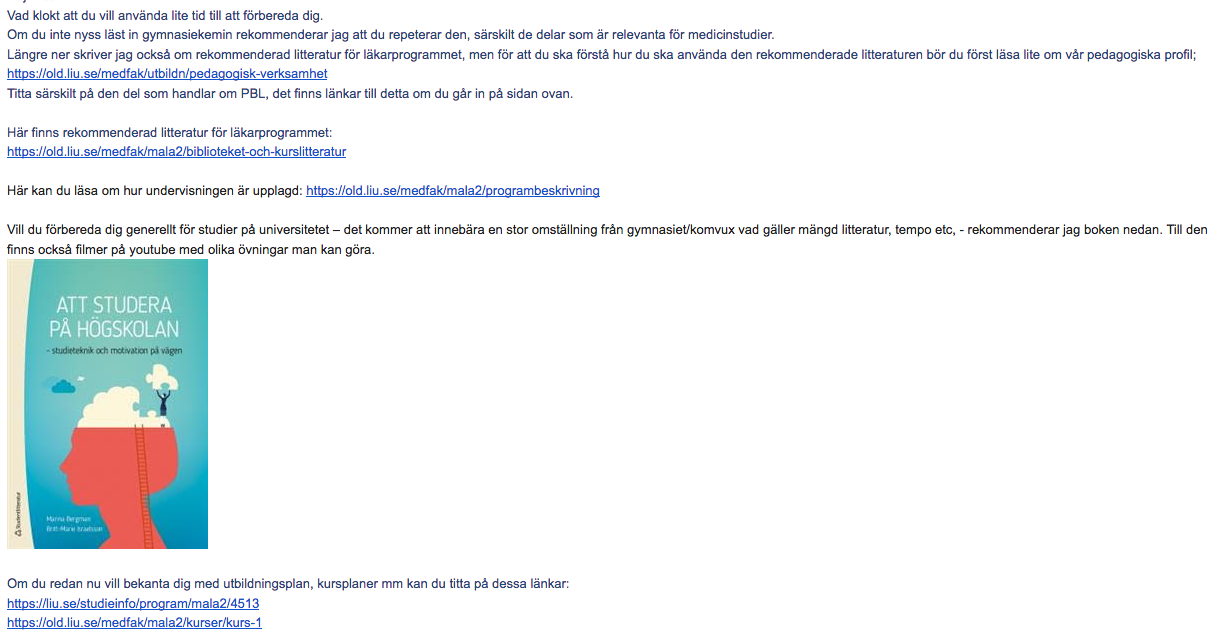

Re: Förberedelse läkarutbildningen
KI har detta uppe som förberedning för T1:
https://pingpong.ki.se/public/courseId/ ... em=3855966
5 år sedan gymnasiet för mig så jag panikpluggar just nu..
https://pingpong.ki.se/public/courseId/ ... em=3855966
5 år sedan gymnasiet för mig så jag panikpluggar just nu..
-
Dr. Faustis
- Newbie-postare

- Inlägg: 24
- Blev medlem: tor 17 okt, 2019 12:22
Re: Förberedelse läkarutbildningen
Linköping blir det! Ja, det blir lite svettigt när det var ett tag sedan man läste på om gymnasiekemi och biologi
-
Hunkmaster
- Före detta VIP-Medlem
- Inlägg: 27
- Blev medlem: ons 02 nov, 2016 11:58
Re: Förberedelse läkarutbildningen
Nice, posta gärna här om du får nåt bra svar!Kunskapärmakt skrev: ↑tis 10 dec, 2019 14:40 Vilket universitet kom du in på, tänkte dra iväg ett mail till Uppsala
Re: Förberedelse läkarutbildningen
Äsch, tror inte det blir jätteansträngande. Du kan nog gallra ganska hårt i kemiboken. Biologi 2 däremot innehöll ganska mycket information om människokroppen, så den rekommenderar jag definitivt. Plugga på väl klasskamrat.Dr. Faustis skrev: ↑tis 10 dec, 2019 14:49 Linköping blir det! Ja, det blir lite svettigt när det var ett tag sedan man läste på om gymnasiekemi och biologi
Re: Förberedelse läkarutbildningen
Jag läser 3e året på läkarprogrammet och min erfarenhet är att man inte behöver förbereda sig så mkt innan. Alla kurser jag haft börjar ofta från the basics. Jag hade inte läst på 6 år men de va inga problem att komma in i det. Men det är klart att det blir lättare ju mer man läser på, men absolut inget man behöver för att klara sig bra  sen är de ju såklart individuellt
sen är de ju såklart individuellt
-
Kunskapärmakt
- Stammis

- Inlägg: 182
- Blev medlem: mån 31 dec, 2018 16:22
Re: Förberedelse läkarutbildningen
Var pluggar du någonstans?seth88 skrev: ↑tis 10 dec, 2019 16:21 Jag läser 3e året på läkarprogrammet och min erfarenhet är att man inte behöver förbereda sig så mkt innan. Alla kurser jag haft börjar ofta från the basics. Jag hade inte läst på 6 år men de va inga problem att komma in i det. Men det är klart att det blir lättare ju mer man läser på, men absolut inget man behöver för att klara sig brasen är de ju såklart individuellt
Re: Förberedelse läkarutbildningen
Göteborg
Re: Förberedelse läkarutbildningen
För några år sedan hade Umeås läkarprogram en "lista" med kemi man kunde repetera innan start. Jag sammanställde ett dokument så kan dela med mig. Vet inte hur man bifogar ett dokument här så klistrar in det här bara. 
Inför läkarprogrammet
Kemi
Periodiska systemet är uppbyggd enligt grupper och perioder. Grupperna är de lodräta raderna. Atomerna i samma grupp har samma antal valenselektroner (nästan alltid), och därmed har de likartade kemiska egenskaper. De vågräta raderna i periodiska systemet kallas perioder. Atomerna i samma period har samma antal elektronskal. Ju längre till vänster vi rör oss i en period desto mer tilltar metallkaraktären. Grupp 1 kallas alkalimetaller, grupp 2 kallas alkaliska jordartsmetaller, grupp 17 hallas halogener (saltbildare) och grupp 18 kallas ädelgaser. Grupp 13-16 har fått namn efter första atomslaget i gruppen, alltså: borgruppen, kolgruppen, kvävegruppen och syregruppen. Grupp 3-12 kallas övergångsmetallerna, de har som regel 1-2 valenselektroner (de kan bilda olika slags joner).
En atom med ädelgasstruktur har ett fullt yttersta elektronskal, ädelgaserna har detta och det är det som gör dem så stabila och att dem ogärna reagerar med andra ämnen. Valenselektronerna är elektronerna i en atoms yttersta skal (valensskalet). Antalet valenselektroner har stor betydelse för vilka kemiska föreningar atomen kan ingå i. Elektronegativitet- en atoms förmåga att attrahera en elektron. Ju mer elektronegativt desto mer drar det till sig elektroner. De ämnen som är mest elektronegativa finner vi uppe till höger i periodiska systemet, N, O, F och Cl.
När en del ämnen reagerar med varandra är skillnaden i elektronegativitet mellan dem så stor att en eller flera elektroner helt övergår från det ena ämnet till det andra. Vid reaktionen bildas det då joner av olika laddning och mellan jonerna uppstår jonbindning. Ex. När natrium reagerar med klor bildas en kristall av natriumklorid. NaCl består av positiva natriumjoner och negativa kloridjoner, de binder till varandra eftersom de har olika laddning. Bindningen kallas jonbindning.
Ett ämne kan även uppnå ädelgasstruktur genom elektronparbindning/kovalent bindning. Ett sätt för en atom att få åtta valenselektroner är att atomerna i en förening delar på ett eller flera elektronpar. En sådan bindning kallas elektronparbindning eller kovalent bindning. Ex. Klor har 7 valenselektroner och vill ha en till för att uppnå ädelgasstruktur, genom att dela ett elektronpar med en annan kloratom uppnås detta. En kovalent bindning har bildats och den kallas enkelbindning. Syre däremot har 6 valenselektroner och vill ha två elektroner till för att uppnå ädelgasstruktur och delar därför med en annan syreatom på två elektronpar och bindningen kallas dubbelbindning, (osv).
En elektronparbindning mellan två likadana atomer är fullständigt kovalent, då de båda atomerna delar helt lika på de gemensamma elektronerna. Men i en molekyl som väteklorid är atomerna mycket olika, de drar olika hårt i de gemensamma elektronerna. Kloratomen är mer elektronegativ än väte och drar mest i elektronerna, klorsidan blir därför lite negativt laddad och vätesidan mer positivt laddad. Det är en polär kovalent bindning mellan atomerna. Väteklorid molekylen är en typisk dipol, vilket innebär att den ena änden av molekylen har en annan laddning en den andra.
Metan, CH4, och koldioxid, CO2, är inte dipoler. Ammoniak, NH3, och vatten, H2O, är dipoler. Hur vet man detta? Man ser det på strukturen, hur elektronerna fördelar sig och räknar elektrontäta områden. Om molekylen är vinklad. En dipol har en positiv och en negativ ände.
Exempelvis diamant och grafit består av samma grundämne (kol) men har mycket olika egenskaper. Detta beror på att det är olika typer av kemisk bindning mellan atomerna. Jonbindingar uppstår mellan en metall och en icke-metall, metallbindningar uppstår mellan metaller och mellan icke-metaller uppstår kovalenta bindningar. Det finns även polära kovalenta bindningar. Alla dessa bindningar kallas intramolekylära, eftersom de påträffas mellan atomerna i en molekyl. Mellan molekyler i ett ämne uppträder en annan slags bindningar, intermolekylära bindningar: dipol-dipol-, väte- och van der Waalsbindningar.
1. Vätebindning: Ett väte binder till kväve, syre eller fluor (NOF-regeln). På grund av att kväve, syre och fluor är mycket elektronegativa och vätet väldigt svagt elektronegativt, kommer elektronmolnet vara starkt förskjutet från vätet och det har skapats en mycket kraftig dipol. Väteatomen kan nästan betraktas som en fri jon som istället kan binda till en annan elektronegativ atom med ett fritt elektronpar. Men nästan omedelbart vänder väteatomen tillbaka till sin ursprungsatom och binder åter till den. Mellan de två elektronegativa atomerna uppstår det därmed med väteatomen som ”budbärare” en slags växelverkan, en bindning. 2. Dipol-dipolbindning: Dipoler vill ligga med den positivt laddade änden riktad mot den negativa. Det uppstår en elektromagnetisk bindning mellan två dipoler. 3. Van der Waalsbindning: En tillfällig dipol-dipol bindning.
Vad händer när natriumklorid löses i vatten? Energi krävs för att bryta jonbindningarna, energin kommer från vattenmolekylernas rörelseenergi, nya bindningar bildas mellan jonerna och vattnet: jon-dipol-bindningar, jonerna hydratiseras- energi frigörs, den frigjorda energin är större en den energi som krävs för att bryta jonbindningarna i saltet. Därför kan saltet lösas i vattnet.
Polaritet- är ett begrepp som innebär att vi har en del av en molekyl som är mer laddad än en annan del av samma molekyl. Hydrofil- exempel en molekyl som gärna löser sig i vatten. Hydrofob- exempel en molekyl som tenderar att inte komma i kontakt med vatten, kan inte lösas i vatten. Detergent- är ett ytaktivt ämne som underlättar bildning av emulsion (en blandning av två vätskor som normalt inte blandar sig lätt, exempel vatten och olja). Molekylerna i en detergent är som regel utsträckta med en hydrofob och en hydrofil ände.
Hydrofob interaktion är en typ av kemisk bindning, där två molekyler i en vattenlösning hålls ihop för att de har hydrofoba (vattenskyende) ytor som det omgivande vattnet inte vill samverka med.
Inom kemin är det ofta intressant att veta om ett ämne är oxiderat eller reducerat. I de allra flesta kemiska reaktioner sker det någon slags överföring av elektroner mellan de ingående grundämnena. För att hålla reda på elektronerna i en reaktion har man infört så kallat oxidationstal (OT). Ex. En aluminiumatom oxiderar och avger 3 e-. Aluminiumjonen får oxidationstalet +III. Oxidationstal brukar anges i romerska siffror.
När ett ämne avger elektroner säger man att det oxideras. När ett ämne tar upp elektroner säger man att det reduceras.
Ex. Trivialnamn: bikarbonat. Systematiskt namn: natriumvätekarbonat NaHCO3.
De 12 kortaste alkanerna är metan, etan, propan, butan, pentan, hexan, heptan, oktan, nonan, dekan, undekan och dodekan.
En radikal är en atom eller molekyl som har oparade elektroner i den yttersta/högsta energinivån (orbitalen). Detta gör ofta radikaler mycket reaktiva, så att de gärna bildar nya kemiska föreningar.
Organisk kemi är vetenskapen om kolföreningarnas kemi. Organiska föreningar innehåller alltid kol och ofta väte, och ofta även andra grundämnen. Atomer som ofta ingår i organiska föreningar är syre, kväve, halogener och ibland fosfor eller svavel. Organiska molekyler som består av enbart kol och väte benämns kolväten.
Inför läkarprogrammet
Kemi
Periodiska systemet är uppbyggd enligt grupper och perioder. Grupperna är de lodräta raderna. Atomerna i samma grupp har samma antal valenselektroner (nästan alltid), och därmed har de likartade kemiska egenskaper. De vågräta raderna i periodiska systemet kallas perioder. Atomerna i samma period har samma antal elektronskal. Ju längre till vänster vi rör oss i en period desto mer tilltar metallkaraktären. Grupp 1 kallas alkalimetaller, grupp 2 kallas alkaliska jordartsmetaller, grupp 17 hallas halogener (saltbildare) och grupp 18 kallas ädelgaser. Grupp 13-16 har fått namn efter första atomslaget i gruppen, alltså: borgruppen, kolgruppen, kvävegruppen och syregruppen. Grupp 3-12 kallas övergångsmetallerna, de har som regel 1-2 valenselektroner (de kan bilda olika slags joner).
En atom med ädelgasstruktur har ett fullt yttersta elektronskal, ädelgaserna har detta och det är det som gör dem så stabila och att dem ogärna reagerar med andra ämnen. Valenselektronerna är elektronerna i en atoms yttersta skal (valensskalet). Antalet valenselektroner har stor betydelse för vilka kemiska föreningar atomen kan ingå i. Elektronegativitet- en atoms förmåga att attrahera en elektron. Ju mer elektronegativt desto mer drar det till sig elektroner. De ämnen som är mest elektronegativa finner vi uppe till höger i periodiska systemet, N, O, F och Cl.
När en del ämnen reagerar med varandra är skillnaden i elektronegativitet mellan dem så stor att en eller flera elektroner helt övergår från det ena ämnet till det andra. Vid reaktionen bildas det då joner av olika laddning och mellan jonerna uppstår jonbindning. Ex. När natrium reagerar med klor bildas en kristall av natriumklorid. NaCl består av positiva natriumjoner och negativa kloridjoner, de binder till varandra eftersom de har olika laddning. Bindningen kallas jonbindning.
Ett ämne kan även uppnå ädelgasstruktur genom elektronparbindning/kovalent bindning. Ett sätt för en atom att få åtta valenselektroner är att atomerna i en förening delar på ett eller flera elektronpar. En sådan bindning kallas elektronparbindning eller kovalent bindning. Ex. Klor har 7 valenselektroner och vill ha en till för att uppnå ädelgasstruktur, genom att dela ett elektronpar med en annan kloratom uppnås detta. En kovalent bindning har bildats och den kallas enkelbindning. Syre däremot har 6 valenselektroner och vill ha två elektroner till för att uppnå ädelgasstruktur och delar därför med en annan syreatom på två elektronpar och bindningen kallas dubbelbindning, (osv).
En elektronparbindning mellan två likadana atomer är fullständigt kovalent, då de båda atomerna delar helt lika på de gemensamma elektronerna. Men i en molekyl som väteklorid är atomerna mycket olika, de drar olika hårt i de gemensamma elektronerna. Kloratomen är mer elektronegativ än väte och drar mest i elektronerna, klorsidan blir därför lite negativt laddad och vätesidan mer positivt laddad. Det är en polär kovalent bindning mellan atomerna. Väteklorid molekylen är en typisk dipol, vilket innebär att den ena änden av molekylen har en annan laddning en den andra.
Metan, CH4, och koldioxid, CO2, är inte dipoler. Ammoniak, NH3, och vatten, H2O, är dipoler. Hur vet man detta? Man ser det på strukturen, hur elektronerna fördelar sig och räknar elektrontäta områden. Om molekylen är vinklad. En dipol har en positiv och en negativ ände.
Exempelvis diamant och grafit består av samma grundämne (kol) men har mycket olika egenskaper. Detta beror på att det är olika typer av kemisk bindning mellan atomerna. Jonbindingar uppstår mellan en metall och en icke-metall, metallbindningar uppstår mellan metaller och mellan icke-metaller uppstår kovalenta bindningar. Det finns även polära kovalenta bindningar. Alla dessa bindningar kallas intramolekylära, eftersom de påträffas mellan atomerna i en molekyl. Mellan molekyler i ett ämne uppträder en annan slags bindningar, intermolekylära bindningar: dipol-dipol-, väte- och van der Waalsbindningar.
1. Vätebindning: Ett väte binder till kväve, syre eller fluor (NOF-regeln). På grund av att kväve, syre och fluor är mycket elektronegativa och vätet väldigt svagt elektronegativt, kommer elektronmolnet vara starkt förskjutet från vätet och det har skapats en mycket kraftig dipol. Väteatomen kan nästan betraktas som en fri jon som istället kan binda till en annan elektronegativ atom med ett fritt elektronpar. Men nästan omedelbart vänder väteatomen tillbaka till sin ursprungsatom och binder åter till den. Mellan de två elektronegativa atomerna uppstår det därmed med väteatomen som ”budbärare” en slags växelverkan, en bindning. 2. Dipol-dipolbindning: Dipoler vill ligga med den positivt laddade änden riktad mot den negativa. Det uppstår en elektromagnetisk bindning mellan två dipoler. 3. Van der Waalsbindning: En tillfällig dipol-dipol bindning.
Vad händer när natriumklorid löses i vatten? Energi krävs för att bryta jonbindningarna, energin kommer från vattenmolekylernas rörelseenergi, nya bindningar bildas mellan jonerna och vattnet: jon-dipol-bindningar, jonerna hydratiseras- energi frigörs, den frigjorda energin är större en den energi som krävs för att bryta jonbindningarna i saltet. Därför kan saltet lösas i vattnet.
Polaritet- är ett begrepp som innebär att vi har en del av en molekyl som är mer laddad än en annan del av samma molekyl. Hydrofil- exempel en molekyl som gärna löser sig i vatten. Hydrofob- exempel en molekyl som tenderar att inte komma i kontakt med vatten, kan inte lösas i vatten. Detergent- är ett ytaktivt ämne som underlättar bildning av emulsion (en blandning av två vätskor som normalt inte blandar sig lätt, exempel vatten och olja). Molekylerna i en detergent är som regel utsträckta med en hydrofob och en hydrofil ände.
Hydrofob interaktion är en typ av kemisk bindning, där två molekyler i en vattenlösning hålls ihop för att de har hydrofoba (vattenskyende) ytor som det omgivande vattnet inte vill samverka med.
Inom kemin är det ofta intressant att veta om ett ämne är oxiderat eller reducerat. I de allra flesta kemiska reaktioner sker det någon slags överföring av elektroner mellan de ingående grundämnena. För att hålla reda på elektronerna i en reaktion har man infört så kallat oxidationstal (OT). Ex. En aluminiumatom oxiderar och avger 3 e-. Aluminiumjonen får oxidationstalet +III. Oxidationstal brukar anges i romerska siffror.
När ett ämne avger elektroner säger man att det oxideras. När ett ämne tar upp elektroner säger man att det reduceras.
Ex. Trivialnamn: bikarbonat. Systematiskt namn: natriumvätekarbonat NaHCO3.
De 12 kortaste alkanerna är metan, etan, propan, butan, pentan, hexan, heptan, oktan, nonan, dekan, undekan och dodekan.
En radikal är en atom eller molekyl som har oparade elektroner i den yttersta/högsta energinivån (orbitalen). Detta gör ofta radikaler mycket reaktiva, så att de gärna bildar nya kemiska föreningar.
Organisk kemi är vetenskapen om kolföreningarnas kemi. Organiska föreningar innehåller alltid kol och ofta väte, och ofta även andra grundämnen. Atomer som ofta ingår i organiska föreningar är syre, kväve, halogener och ibland fosfor eller svavel. Organiska molekyler som består av enbart kol och väte benämns kolväten.
Re: Förberedelse läkarutbildningen
Jag studerar på Ki & när vi började fick vi meddelande om att det vore bra att repetera nedanstående moment. Lycka till!!
Fysik: Atomens uppbyggnad och olika energiformer. Atomorbitaler. Begreppen valenselektroner och oktettregeln.
Kemi: Periodiska systemets organisation (OBS ej alla grundämnen). Begreppen atommassa, molmassa, mol, molar, koncentration. Olika typer av kemisk bindning (kovalent resp. icke kovalent [jonbindning, vätebindning, van der Waalsinteraktion, hydrofob interaktion]). Vatten som lösningsmedel, begreppen solvatisering och hydratisering. Elektronegativitet och polaritet. Jämvikter, massverkans lag. Oorganiska syror och baser. Protolys, pH-begreppet (logaritmer!!), vattnets jonprodukt, amfolyter, syrakonstant. Buffertar. Enkla organiska föreningar, struktur, egenskaper, nomenklatur, isomeri. Begreppen energi, entalpi och entropi. Några kemiska begrepp/namn som du skall kunna definiera och beskriva med strukturformler är: aldehyd, keton, karboxylsyra, ester, aromat, ammoniak, amin, karbonylgrupp, hydroxylgrupp, karboxylgrupp, acetyl- och acylgrupp, metylgrupp, metylengrupp, fenylgrupp, tiolgrupp. Redogöra för begreppen oxidation och reduktion samt kunna förklara och definiera de stereokemiska begreppen cis‑trans‑isomeri och optiska isomerer (D/L) av aminosyror och kolhydrater. Du skall kunna redogöra för följande strukturer (glukos, fruktos, ribos och deoxyribos). Du skall känna till parametrar som är av betydelse för ett ämnes reaktionsbenägenhet (resonanseffekter, steriska effekter, induktiva effekter.
Biokemi och cellbiologi: Allmänna kunskaper om cellens uppbyggnad och dess kemiska byggstenar och/eller makromolekyler (aminosyror, proteiner, enzymer, vitaminer, lipider och kolhydrater samt nukleinsyrorna DNA och RNA) bör du också repetera.
Matematik: 10-logaritmer samt naturliga logaritmer, potensräkning, kvadratroten, diagramritning, vad som menas med en sigmoid-, parabol- och hyperbol-kurva. Räta linjens ekvation samt kunna lösa ett ekvationssystem.
Fysik: Atomens uppbyggnad och olika energiformer. Atomorbitaler. Begreppen valenselektroner och oktettregeln.
Kemi: Periodiska systemets organisation (OBS ej alla grundämnen). Begreppen atommassa, molmassa, mol, molar, koncentration. Olika typer av kemisk bindning (kovalent resp. icke kovalent [jonbindning, vätebindning, van der Waalsinteraktion, hydrofob interaktion]). Vatten som lösningsmedel, begreppen solvatisering och hydratisering. Elektronegativitet och polaritet. Jämvikter, massverkans lag. Oorganiska syror och baser. Protolys, pH-begreppet (logaritmer!!), vattnets jonprodukt, amfolyter, syrakonstant. Buffertar. Enkla organiska föreningar, struktur, egenskaper, nomenklatur, isomeri. Begreppen energi, entalpi och entropi. Några kemiska begrepp/namn som du skall kunna definiera och beskriva med strukturformler är: aldehyd, keton, karboxylsyra, ester, aromat, ammoniak, amin, karbonylgrupp, hydroxylgrupp, karboxylgrupp, acetyl- och acylgrupp, metylgrupp, metylengrupp, fenylgrupp, tiolgrupp. Redogöra för begreppen oxidation och reduktion samt kunna förklara och definiera de stereokemiska begreppen cis‑trans‑isomeri och optiska isomerer (D/L) av aminosyror och kolhydrater. Du skall kunna redogöra för följande strukturer (glukos, fruktos, ribos och deoxyribos). Du skall känna till parametrar som är av betydelse för ett ämnes reaktionsbenägenhet (resonanseffekter, steriska effekter, induktiva effekter.
Biokemi och cellbiologi: Allmänna kunskaper om cellens uppbyggnad och dess kemiska byggstenar och/eller makromolekyler (aminosyror, proteiner, enzymer, vitaminer, lipider och kolhydrater samt nukleinsyrorna DNA och RNA) bör du också repetera.
Matematik: 10-logaritmer samt naturliga logaritmer, potensräkning, kvadratroten, diagramritning, vad som menas med en sigmoid-, parabol- och hyperbol-kurva. Räta linjens ekvation samt kunna lösa ett ekvationssystem.
-
Dr. Faustis
- Newbie-postare

- Inlägg: 24
- Blev medlem: tor 17 okt, 2019 12:22
Re: Förberedelse läkarutbildningen
Panda skrev: ↑tor 12 dec, 2019 18:07 För några år sedan hade Umeås läkarprogram en "lista" med kemi man kunde repetera innan start. Jag sammanställde ett dokument så kan dela med mig. Vet inte hur man bifogar ett dokument här så klistrar in det här bara.
Inför läkarprogrammet
Kemi
Periodiska systemet är uppbyggd enligt grupper och perioder. Grupperna är de lodräta raderna. Atomerna i samma grupp har samma antal valenselektroner (nästan alltid), och därmed har de likartade kemiska egenskaper. De vågräta raderna i periodiska systemet kallas perioder. Atomerna i samma period har samma antal elektronskal. Ju längre till vänster vi rör oss i en period desto mer tilltar metallkaraktären. Grupp 1 kallas alkalimetaller, grupp 2 kallas alkaliska jordartsmetaller, grupp 17 hallas halogener (saltbildare) och grupp 18 kallas ädelgaser. Grupp 13-16 har fått namn efter första atomslaget i gruppen, alltså: borgruppen, kolgruppen, kvävegruppen och syregruppen. Grupp 3-12 kallas övergångsmetallerna, de har som regel 1-2 valenselektroner (de kan bilda olika slags joner).
En atom med ädelgasstruktur har ett fullt yttersta elektronskal, ädelgaserna har detta och det är det som gör dem så stabila och att dem ogärna reagerar med andra ämnen. Valenselektronerna är elektronerna i en atoms yttersta skal (valensskalet). Antalet valenselektroner har stor betydelse för vilka kemiska föreningar atomen kan ingå i. Elektronegativitet- en atoms förmåga att attrahera en elektron. Ju mer elektronegativt desto mer drar det till sig elektroner. De ämnen som är mest elektronegativa finner vi uppe till höger i periodiska systemet, N, O, F och Cl.
När en del ämnen reagerar med varandra är skillnaden i elektronegativitet mellan dem så stor att en eller flera elektroner helt övergår från det ena ämnet till det andra. Vid reaktionen bildas det då joner av olika laddning och mellan jonerna uppstår jonbindning. Ex. När natrium reagerar med klor bildas en kristall av natriumklorid. NaCl består av positiva natriumjoner och negativa kloridjoner, de binder till varandra eftersom de har olika laddning. Bindningen kallas jonbindning.
Ett ämne kan även uppnå ädelgasstruktur genom elektronparbindning/kovalent bindning. Ett sätt för en atom att få åtta valenselektroner är att atomerna i en förening delar på ett eller flera elektronpar. En sådan bindning kallas elektronparbindning eller kovalent bindning. Ex. Klor har 7 valenselektroner och vill ha en till för att uppnå ädelgasstruktur, genom att dela ett elektronpar med en annan kloratom uppnås detta. En kovalent bindning har bildats och den kallas enkelbindning. Syre däremot har 6 valenselektroner och vill ha två elektroner till för att uppnå ädelgasstruktur och delar därför med en annan syreatom på två elektronpar och bindningen kallas dubbelbindning, (osv).
En elektronparbindning mellan två likadana atomer är fullständigt kovalent, då de båda atomerna delar helt lika på de gemensamma elektronerna. Men i en molekyl som väteklorid är atomerna mycket olika, de drar olika hårt i de gemensamma elektronerna. Kloratomen är mer elektronegativ än väte och drar mest i elektronerna, klorsidan blir därför lite negativt laddad och vätesidan mer positivt laddad. Det är en polär kovalent bindning mellan atomerna. Väteklorid molekylen är en typisk dipol, vilket innebär att den ena änden av molekylen har en annan laddning en den andra.
Metan, CH4, och koldioxid, CO2, är inte dipoler. Ammoniak, NH3, och vatten, H2O, är dipoler. Hur vet man detta? Man ser det på strukturen, hur elektronerna fördelar sig och räknar elektrontäta områden. Om molekylen är vinklad. En dipol har en positiv och en negativ ände.
Exempelvis diamant och grafit består av samma grundämne (kol) men har mycket olika egenskaper. Detta beror på att det är olika typer av kemisk bindning mellan atomerna. Jonbindingar uppstår mellan en metall och en icke-metall, metallbindningar uppstår mellan metaller och mellan icke-metaller uppstår kovalenta bindningar. Det finns även polära kovalenta bindningar. Alla dessa bindningar kallas intramolekylära, eftersom de påträffas mellan atomerna i en molekyl. Mellan molekyler i ett ämne uppträder en annan slags bindningar, intermolekylära bindningar: dipol-dipol-, väte- och van der Waalsbindningar.
1. Vätebindning: Ett väte binder till kväve, syre eller fluor (NOF-regeln). På grund av att kväve, syre och fluor är mycket elektronegativa och vätet väldigt svagt elektronegativt, kommer elektronmolnet vara starkt förskjutet från vätet och det har skapats en mycket kraftig dipol. Väteatomen kan nästan betraktas som en fri jon som istället kan binda till en annan elektronegativ atom med ett fritt elektronpar. Men nästan omedelbart vänder väteatomen tillbaka till sin ursprungsatom och binder åter till den. Mellan de två elektronegativa atomerna uppstår det därmed med väteatomen som ”budbärare” en slags växelverkan, en bindning. 2. Dipol-dipolbindning: Dipoler vill ligga med den positivt laddade änden riktad mot den negativa. Det uppstår en elektromagnetisk bindning mellan två dipoler. 3. Van der Waalsbindning: En tillfällig dipol-dipol bindning.
Vad händer när natriumklorid löses i vatten? Energi krävs för att bryta jonbindningarna, energin kommer från vattenmolekylernas rörelseenergi, nya bindningar bildas mellan jonerna och vattnet: jon-dipol-bindningar, jonerna hydratiseras- energi frigörs, den frigjorda energin är större en den energi som krävs för att bryta jonbindningarna i saltet. Därför kan saltet lösas i vattnet.
Polaritet- är ett begrepp som innebär att vi har en del av en molekyl som är mer laddad än en annan del av samma molekyl. Hydrofil- exempel en molekyl som gärna löser sig i vatten. Hydrofob- exempel en molekyl som tenderar att inte komma i kontakt med vatten, kan inte lösas i vatten. Detergent- är ett ytaktivt ämne som underlättar bildning av emulsion (en blandning av två vätskor som normalt inte blandar sig lätt, exempel vatten och olja). Molekylerna i en detergent är som regel utsträckta med en hydrofob och en hydrofil ände.
Hydrofob interaktion är en typ av kemisk bindning, där två molekyler i en vattenlösning hålls ihop för att de har hydrofoba (vattenskyende) ytor som det omgivande vattnet inte vill samverka med.
Inom kemin är det ofta intressant att veta om ett ämne är oxiderat eller reducerat. I de allra flesta kemiska reaktioner sker det någon slags överföring av elektroner mellan de ingående grundämnena. För att hålla reda på elektronerna i en reaktion har man infört så kallat oxidationstal (OT). Ex. En aluminiumatom oxiderar och avger 3 e-. Aluminiumjonen får oxidationstalet +III. Oxidationstal brukar anges i romerska siffror.
När ett ämne avger elektroner säger man att det oxideras. När ett ämne tar upp elektroner säger man att det reduceras.
Ex. Trivialnamn: bikarbonat. Systematiskt namn: natriumvätekarbonat NaHCO3.
De 12 kortaste alkanerna är metan, etan, propan, butan, pentan, hexan, heptan, oktan, nonan, dekan, undekan och dodekan.
En radikal är en atom eller molekyl som har oparade elektroner i den yttersta/högsta energinivån (orbitalen). Detta gör ofta radikaler mycket reaktiva, så att de gärna bildar nya kemiska föreningar.
Organisk kemi är vetenskapen om kolföreningarnas kemi. Organiska föreningar innehåller alltid kol och ofta väte, och ofta även andra grundämnen. Atomer som ofta ingår i organiska föreningar är syre, kväve, halogener och ibland fosfor eller svavel. Organiska molekyler som består av enbart kol och väte benämns kolväten.
Är det verkligen sånt här som man ska läsa om igen? Elektronegativiteter, atomnummer och ädelgasstrukturer? Kommentaren från KI om molberäkning och stökiometri känns också jättemärklig. Även mattendelen med ekvationssystem och räta linjen. Känns inte som det stämmer? Någon som vet specifikt för Linköping?
Re: Förberedelse läkarutbildningen
Jag kopierade bara meddelandet vi fick i T1 om repetition rakt av. Men om jag skulle rekommendera dig vad jag -personligen- tycker kan vara bra att repetera inför T1 så skulle jag rekommendera följande: Cellens organeller, dess funktioner, glykolysen, citronsyracykeln, elektrontransportkedjan, oxidativ fosforylering... and thats it. Mycket av det som "rekommenderas" har då jag iaf aldrig kommit över under T1. Om du stundar i repetition innan kursstart så är det inte hela världen heller. Du kommer snabbt in i det. Kan som sagt bara tala utifrån Ki, vet inte hur det är på övriga lärosäten, men sån stor skillnad tänker jag att det inte kan vara.
Re: Förberedelse läkarutbildningen
Ja i Umeå la de upp ett dokument med frågor, och ovanstående är mina sammanställda svar på frågorna. Dock var ju detta några år sedan, nu hittar jag den inte på nätet.. Så vet inte om de fortfarande använder den listan. Jag har ju inte heller blivit antagen till något läkarprogram.. då kanske man får annan info..Dr. Faustis skrev: ↑fre 13 dec, 2019 10:50Panda skrev: ↑tor 12 dec, 2019 18:07 För några år sedan hade Umeås läkarprogram en "lista" med kemi man kunde repetera innan start. Jag sammanställde ett dokument så kan dela med mig. Vet inte hur man bifogar ett dokument här så klistrar in det här bara.
Inför läkarprogrammet
Kemi
Periodiska systemet är uppbyggd enligt grupper och perioder. Grupperna är de lodräta raderna. Atomerna i samma grupp har samma antal valenselektroner (nästan alltid), och därmed har de likartade kemiska egenskaper. De vågräta raderna i periodiska systemet kallas perioder. Atomerna i samma period har samma antal elektronskal. Ju längre till vänster vi rör oss i en period desto mer tilltar metallkaraktären. Grupp 1 kallas alkalimetaller, grupp 2 kallas alkaliska jordartsmetaller, grupp 17 hallas halogener (saltbildare) och grupp 18 kallas ädelgaser. Grupp 13-16 har fått namn efter första atomslaget i gruppen, alltså: borgruppen, kolgruppen, kvävegruppen och syregruppen. Grupp 3-12 kallas övergångsmetallerna, de har som regel 1-2 valenselektroner (de kan bilda olika slags joner).
En atom med ädelgasstruktur har ett fullt yttersta elektronskal, ädelgaserna har detta och det är det som gör dem så stabila och att dem ogärna reagerar med andra ämnen. Valenselektronerna är elektronerna i en atoms yttersta skal (valensskalet). Antalet valenselektroner har stor betydelse för vilka kemiska föreningar atomen kan ingå i. Elektronegativitet- en atoms förmåga att attrahera en elektron. Ju mer elektronegativt desto mer drar det till sig elektroner. De ämnen som är mest elektronegativa finner vi uppe till höger i periodiska systemet, N, O, F och Cl.
När en del ämnen reagerar med varandra är skillnaden i elektronegativitet mellan dem så stor att en eller flera elektroner helt övergår från det ena ämnet till det andra. Vid reaktionen bildas det då joner av olika laddning och mellan jonerna uppstår jonbindning. Ex. När natrium reagerar med klor bildas en kristall av natriumklorid. NaCl består av positiva natriumjoner och negativa kloridjoner, de binder till varandra eftersom de har olika laddning. Bindningen kallas jonbindning.
Ett ämne kan även uppnå ädelgasstruktur genom elektronparbindning/kovalent bindning. Ett sätt för en atom att få åtta valenselektroner är att atomerna i en förening delar på ett eller flera elektronpar. En sådan bindning kallas elektronparbindning eller kovalent bindning. Ex. Klor har 7 valenselektroner och vill ha en till för att uppnå ädelgasstruktur, genom att dela ett elektronpar med en annan kloratom uppnås detta. En kovalent bindning har bildats och den kallas enkelbindning. Syre däremot har 6 valenselektroner och vill ha två elektroner till för att uppnå ädelgasstruktur och delar därför med en annan syreatom på två elektronpar och bindningen kallas dubbelbindning, (osv).
En elektronparbindning mellan två likadana atomer är fullständigt kovalent, då de båda atomerna delar helt lika på de gemensamma elektronerna. Men i en molekyl som väteklorid är atomerna mycket olika, de drar olika hårt i de gemensamma elektronerna. Kloratomen är mer elektronegativ än väte och drar mest i elektronerna, klorsidan blir därför lite negativt laddad och vätesidan mer positivt laddad. Det är en polär kovalent bindning mellan atomerna. Väteklorid molekylen är en typisk dipol, vilket innebär att den ena änden av molekylen har en annan laddning en den andra.
Metan, CH4, och koldioxid, CO2, är inte dipoler. Ammoniak, NH3, och vatten, H2O, är dipoler. Hur vet man detta? Man ser det på strukturen, hur elektronerna fördelar sig och räknar elektrontäta områden. Om molekylen är vinklad. En dipol har en positiv och en negativ ände.
Exempelvis diamant och grafit består av samma grundämne (kol) men har mycket olika egenskaper. Detta beror på att det är olika typer av kemisk bindning mellan atomerna. Jonbindingar uppstår mellan en metall och en icke-metall, metallbindningar uppstår mellan metaller och mellan icke-metaller uppstår kovalenta bindningar. Det finns även polära kovalenta bindningar. Alla dessa bindningar kallas intramolekylära, eftersom de påträffas mellan atomerna i en molekyl. Mellan molekyler i ett ämne uppträder en annan slags bindningar, intermolekylära bindningar: dipol-dipol-, väte- och van der Waalsbindningar.
1. Vätebindning: Ett väte binder till kväve, syre eller fluor (NOF-regeln). På grund av att kväve, syre och fluor är mycket elektronegativa och vätet väldigt svagt elektronegativt, kommer elektronmolnet vara starkt förskjutet från vätet och det har skapats en mycket kraftig dipol. Väteatomen kan nästan betraktas som en fri jon som istället kan binda till en annan elektronegativ atom med ett fritt elektronpar. Men nästan omedelbart vänder väteatomen tillbaka till sin ursprungsatom och binder åter till den. Mellan de två elektronegativa atomerna uppstår det därmed med väteatomen som ”budbärare” en slags växelverkan, en bindning. 2. Dipol-dipolbindning: Dipoler vill ligga med den positivt laddade änden riktad mot den negativa. Det uppstår en elektromagnetisk bindning mellan två dipoler. 3. Van der Waalsbindning: En tillfällig dipol-dipol bindning.
Vad händer när natriumklorid löses i vatten? Energi krävs för att bryta jonbindningarna, energin kommer från vattenmolekylernas rörelseenergi, nya bindningar bildas mellan jonerna och vattnet: jon-dipol-bindningar, jonerna hydratiseras- energi frigörs, den frigjorda energin är större en den energi som krävs för att bryta jonbindningarna i saltet. Därför kan saltet lösas i vattnet.
Polaritet- är ett begrepp som innebär att vi har en del av en molekyl som är mer laddad än en annan del av samma molekyl. Hydrofil- exempel en molekyl som gärna löser sig i vatten. Hydrofob- exempel en molekyl som tenderar att inte komma i kontakt med vatten, kan inte lösas i vatten. Detergent- är ett ytaktivt ämne som underlättar bildning av emulsion (en blandning av två vätskor som normalt inte blandar sig lätt, exempel vatten och olja). Molekylerna i en detergent är som regel utsträckta med en hydrofob och en hydrofil ände.
Hydrofob interaktion är en typ av kemisk bindning, där två molekyler i en vattenlösning hålls ihop för att de har hydrofoba (vattenskyende) ytor som det omgivande vattnet inte vill samverka med.
Inom kemin är det ofta intressant att veta om ett ämne är oxiderat eller reducerat. I de allra flesta kemiska reaktioner sker det någon slags överföring av elektroner mellan de ingående grundämnena. För att hålla reda på elektronerna i en reaktion har man infört så kallat oxidationstal (OT). Ex. En aluminiumatom oxiderar och avger 3 e-. Aluminiumjonen får oxidationstalet +III. Oxidationstal brukar anges i romerska siffror.
När ett ämne avger elektroner säger man att det oxideras. När ett ämne tar upp elektroner säger man att det reduceras.
Ex. Trivialnamn: bikarbonat. Systematiskt namn: natriumvätekarbonat NaHCO3.
De 12 kortaste alkanerna är metan, etan, propan, butan, pentan, hexan, heptan, oktan, nonan, dekan, undekan och dodekan.
En radikal är en atom eller molekyl som har oparade elektroner i den yttersta/högsta energinivån (orbitalen). Detta gör ofta radikaler mycket reaktiva, så att de gärna bildar nya kemiska föreningar.
Organisk kemi är vetenskapen om kolföreningarnas kemi. Organiska föreningar innehåller alltid kol och ofta väte, och ofta även andra grundämnen. Atomer som ofta ingår i organiska föreningar är syre, kväve, halogener och ibland fosfor eller svavel. Organiska molekyler som består av enbart kol och väte benämns kolväten.
Är det verkligen sånt här som man ska läsa om igen? Elektronegativiteter, atomnummer och ädelgasstrukturer? Kommentaren från KI om molberäkning och stökiometri känns också jättemärklig. Även mattendelen med ekvationssystem och räta linjen. Känns inte som det stämmer? Någon som vet specifikt för Linköping?